LES LYMPHATIQUES DANS LE CERVEAU
Découverte d’une structure anatomique improbable : une quatrième méninge enveloppant le cerveau
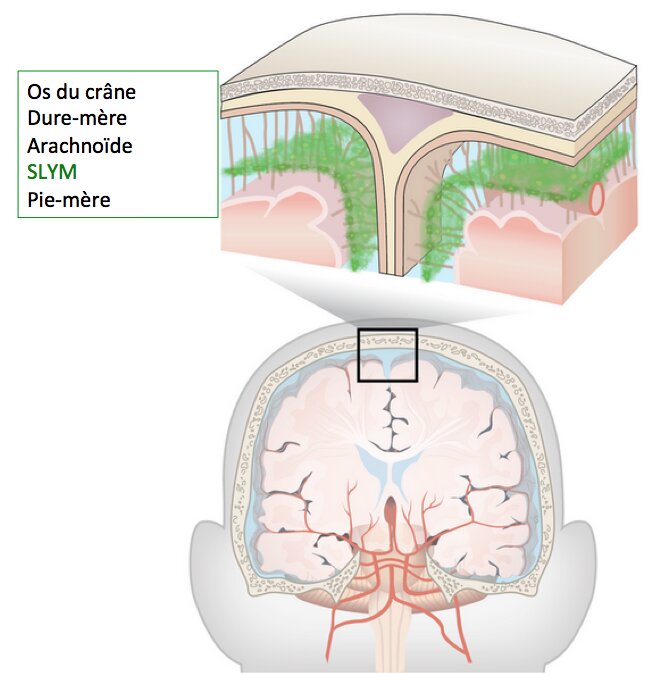
Une nouvelle structure anatomique dans le cerveau a été baptisée SLYM, pour subarachnoid lymphatic-like membrane
(membrane sous-arachnoïdienne de type lymphatique). © Université de Copenhague
Les traités de neuroanatomie vont devoir désormais remettre une couche au chapitre consacré aux méninges, ces membranes qui enveloppent la totalité du système nerveux central. Après la dure-mère, l’arachnoïde et la pie-mère, il faut désormais compter avec une quatrième membrane méningée, baptisée SLYM, pour subarachnoid lymphatic-like membrane (membrane sous-arachnoïdienne de type lymphatique).
Des biologistes de l’université de Copenhague et de l’université de Rochester (État de New York) rapportent, dans le numéro de la revue Science daté du 6 janvier 2023, avoir identifié, chez la souris et chez l’homme, l’existence d’une très fine membrane recouvrant le cerveau. Il existe donc quatre méninges, et non trois comme on l’a toujours appris. Cette méninge nouvellement identifiée est composée d’une couche continue de cellules aplaties mêlées à un réseau peu dense de fibres de collagène.
L’épaisseur de cette méninge nouvellement identifiée est extrêmement faible, de l’ordre de 14,2 ± 0,5 micromètres, donc plus fine que celle de la dure-mère (21,8 ± 1,3 micromètres). Jusqu’à présent, cette membrane quasiment invisible, car composée d’une couche d’une ou de quelques cellules, n’avait pas été décrite par les neuroanatomistes, ni même observée à l’imagerie du cerveau.
Cette découverte s’ajoute à celle qui, en 2012, a mis en évidence un système de circulation intracérébrale du liquide céphalorachidien, baptisé « système glymphatique », terme forgé à partir de « glie » (cellules gliales) et « lymphatique ».
Ce système assure le drainage des liquides entre les cellules (appelés fluides interstitiels cérébraux) depuis et vers le liquide céphalo-rachidien (LCR). Le système glymphatique permettrait d’évacuer ces déchets, autrement dit de nettoyer le cerveau. Il serait impliqué dans plusieurs pathologies cérébrales. Il empêcherait l’accumulation de substances neurotoxiques, notamment la protéine β-amyloïde, dont on observe des dépôts dans la maladie d’Alzheimer.
En 2015, des chercheurs avaient découvert, contre toute attente, l’existence de véritables vaisseaux lymphatiques intracrâniens, situés dans la dure-mère le long des sinus veineux. Il avait alors été montré qu’un traceur fluorescent injecté dans le LCR peut être détecté trente minutes plus tard dans le parenchyme cérébral, ce qui atteste le passage du LCR à l’intérieur du cerveau. Ainsi, des vaisseaux lymphatiques méningés complètent le système glymphatique cérébral et participent à l’élimination de certaines molécules. Ce système lymphatique participe également à la surveillance immunitaire du système nerveux central.
Membrane identifiée par marquage avec une protéine fluorescente
Mais revenons à la découverte de la méninge baptisée SLYM. Chez la souris, les chercheurs ont créé un volet osseux en regard du cortex. La SLYM a pu être visualisée en microscopie par excitation à deux photons en utilisant un marqueur génétique, couplé à l’expression d’une protéine (EGFP, enhanced green fluorescent protein), ayant la propriété d’émettre une fluorescence de couleur verte.
Le marqueur génétique utilisé est le facteur de transcription Prox1, dont l’expression est essentielle à la différenciation des cellules endothéliales des vaisseaux lymphatiques. L’expression de ce gène s’accompagne alors d’une fluorescence verte dans les cellules dans lesquelles il s’exprime. D’autres techniques ont été utilisées pour visualiser les fibres de collagène, le réseau vasculaire et certaines cellules cérébrales (astrocytes).
Sous la dure-mère, une couche de cellules aplaties
C’est alors que les biologistes cellulaires ont eu la surprise de découvrir la présence d’une monocouche de cellules aplaties, colorées en vert, car exprimant le facteur de transcription Prox1, couplé à la protéine fluorescente EGFP. Cette membrane ultrafine divise l’espace sous-arachnoïdien en deux compartiments.
Ces expériences d’immunohistochimie ont donc montré que la SLYM est une membrane composée de cellules dénommées Prox1-EGFP+. Celles-ci expriment deux autres marqueurs : la protéine PDPN (ou podoplanine), spécifiquement exprimée dans les cellules des capillaires lymphatiques) et la protéine CRABP2, uniquement exprimée lors du développement précoce des cellules de la dure-mère et de l’arachnoïde.
Méninge du quatrième type
Cette membrane exprimant PDPN et CRABP2 est située au-dessus de la pie-mère recouvrant le cerveau adulte humain. Elle est présente dans tout l’espace sous-arachnoïdien. Cette membrane extrêmement fine entoure donc la totalité du cerveau humain.
La SLYM exprime certains marqueurs caractéristiques du système lymphatique (notamment Prox1-EGFP+, PDPN+, CRABP2+). Plusieurs autres marqueurs (immunophénotypage par des anticorps spécifiques), permettent de différencier la SLYM de la dure-mère, l’arachnoïde et la pie-mère. La SLYM constitue donc une quatrième membrane méningée, distincte des trois autres méninges sur les plans morphologique et immunophénotypique.
Il s’avère que la SLYM exprime donc la protéine PDPN. Cette méninge partage cette caractéristique avec ce que l’on appelle un mésothélium, à savoir des couches très fines de cellules qui constituent la bordure des cavités internes de l’organisme. Chez le fœtus humain, une membrane exprimant également PDPN correspondant au péricarde, à la plèvre et au péritoine, enveloppe respectivement le cœur, les poumons et les intestins.
Un mésothélium est présent là où des tissus entrent en contact les uns avec les autres et semble agir comme une sorte de lubrifiant permettant de faciliter les mouvements des organes proches les uns des autres.
Selon Kjeld Møllgård, professeur de neuroanatomie à l’université de Copenhague, Maiken Nedergaard (co-directrice du centre de neuromédecine translationnelle de l’Université de Rochester et professeure à l’université de Copenhague), et leurs collègues, la SLYM apparaît représenter le mésothélium du cerveau. Les pulsations générées par le système cardiovasculaire, la respiration et les changements de position de la tête déplacent constamment le cerveau à l’intérieur de la cavité crânienne. Selon les chercheurs, la SLYM pourrait, comme d’autres membranes mésothéliales, réduire la friction entre le cerveau et le crâne lors de tels mouvements.
Division de l’espace sous-arachnoïdien en deux compartiments
Les chercheurs ont observé que cette membrane contribue à compartimenter l’espace sous-arachnoïdien en deux sous-espaces, l’un externe, superficiel, et un second, interne, qui longe le cerveau. En d’autres termes, il existe dans cet espace délimité entre la pie-mère et l’arachnoïde, une fine membrane qui constitue une méninge. Celle-ci est parcourue par des vaisseaux sanguins et héberge des cellules immunitaires.
La SLYM est une membrane qui ne laisse pas passer des solutés dépassant les 3 kilodaltons entre les deux compartiments qu’elle délimite. Le kilodalton est une unité utilisée pour décrire le poids moléculaire de grosses molécules, telles que les protéines. La SLYM se comporte donc comme une barrière qui s’oppose à la traversée de la plupart des protéines entre les compartiments sous-arachnoïdiens supérieur et inférieur qu’elle délimite.
Barrière immunitaire
Les mésothéliums qui entourent les organes périphériques agissement également comme des barrières immunitaires. La SLYM pourrait-elle également jouer un rôle de barrière protectrice en empêchant que des particules étrangères pénètrent dans le liquide céphalo-rachidien ? Il s’avère que la dure-mère et la SLYM renferment une quantité comparable de cellules immunitaires (leucocytes), ce qui indique que la SLYM joue sans doute un rôle majeur dans les réponses immunes au niveau cérébral.
Autre question que les chercheurs se sont posée : une inflammation généralisée (systémique) affecte-t-elle des cellules immunitaires résidant dans la SLYM ? Et qu’en est-il de son rôle dans le vieillissement physiologique, sachant que la fonction de drainage du système glymphatique diminue avec l’âge chez la souris ?
Il s’avère que chez des souris vieillissantes ou chez lesquelles on a expérimentalement induit une inflammation aiguë, on observe au sein de la SLYM la présence de globules blancs (cellules CD45+), de même que d’autres cellules immunitaires, recrutées sur place ou qui y prolifèrent.
La SLYM apparaît donc fonctionner comme une zone dédiée à la surveillance immunitaire. Selon les chercheurs, « la SLYM remplit les caractéristiques d’un mésothélium en agissant comme une barrière immunitaire qui empêche le passage de petits solutés entre les espaces sous-arachnoïdiens externe et interne, et en recouvrant le réseau vasculaire de l’espace sous-arachnoïdien interne ».
Par ailleurs, les chercheurs ont observé que la SLYM est, à certains endroits, directement au contact des cellules endothéliales des sinus veineux méningés. Cette proximité immédiate entre la SLYM et les cellules tapissant l’intérieur de vaisseaux sanguins permet un échange direct de petits solutés entre le sang veineux et le liquide céphalo-rachidien (LCR).
Les expériences conduites par les chercheurs montrent que la SLYM pourrait guider le flux de liquide céphalo-rachidien le long des artérioles qui pénètrent dans le parenchyme cérébral. La SLYM, en tant quatrième méninge, pourrait donc jouer un rôle essentiel au-delà du simple transport du LCR.
Possible implication de la SLYM dans des pathologies cérébrales traumatiques ou dysimmunitaires
Toujours selon les auteurs, une brèche d’origine traumatique dans la SLYM pourrait altérer la circulation du LCR, ce qui expliquerait l’interruption prolongée du système glymphatique après lésion traumatique du cerveau ou le risque accru, récemment décrit, de développer une maladie d’Alzheimer après traumatisme cérébral. Par ailleurs, l’hypothèse d’un dysfonctionnement du système glymphatique dans la maladie d’Alzheimer a récemment été formulée.
Une rupture de la SLYM permettrait également à des cellules immunitaires, contenues dans la moelle osseuse de la voûte crânienne, de pénétrer directement dans l’espace sous-arachnoïdien interne et d’avoir ainsi un accès direct à la surface du cerveau, ce qui pourrait expliquer l’inflammation prolongée après un traumatisme crânien.
Enfin, toujours selon les chercheurs, la SLYM pourrait être impliquée dans l’immunité du système nerveux central, dans la mesure où les compartiments méningés semblent jouer un grand rôle dans les processus neuro-inflammatoires, et donc possiblement dans la sclérose en plaques.
Une meilleure définition de l’anatomie des méninges, associée aux connaissances récentes sur le fonctionnement du système glymphatique et des vaisseaux lymphatiques intracrâniens, laisse espérer des avancées notables en physiologie cérébrale ainsi que sur l’origine de certaines pathologies neurologiques. Depuis peu, les systèmes méningés glymphatique et lymphatique constituent de nouvelles cibles thérapeutiques, avec pour double objectif d’améliorer le drainage cérébral et de renforcer la surveillance immunitaire au niveau du cerveau.
PUBLIÉ LE 09 JANVIER 2023 PAR MARC GOZLAN
Pour en savoir plus :
Møllgård K, Beinlich FRM, Kusk P, et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 2023 Jan 6;379(6627):84-88. doi: 10.1126/science.adc8810
Mohamed AZ, Cumming P, Götz J, et al. Tauopathy in veterans with long-term posttraumatic stress disorder and traumatic brain injury. Eur J Nucl Med Mol Imaging. 2019 May;46(5):1139-1151. doi: 10.1007/s00259-018-4241-7
Da Mesquita S, Louveau A, Vaccari A, et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer’s disease. Nature. 2018 Aug;560(7717):185-191. doi: 10.1038/s41586-018-0368-8
Louveau A, Plog BA, Antila S, Alitalo K, et al. Understanding the functions and relationships of the glymphatic system and meningeal lymphatics. J Clin Invest. 2017 Sep 1;127(9):3210-3219. doi: 10.1172/JCI90603
Pikor NB, Prat A, Bar-Or A, Gommerman JL. Meningeal Tertiary Lymphoid Tissues and Multiple Sclerosis: A Gathering Place for Diverse Types of Immune Cells during CNS Autoimmunity. Front Immunol. 2016 Jan 13;6:657. doi: 10.3389/fimmu.2015.00657
Jessen NA, Munk AS, Lundgaard I, Nedergaard M. The Glymphatic System: A Beginner’s Guide. Neurochem Res. 2015 Dec;40(12):2583-99. doi: 10.1007/s11064-015-1581-6
Louveau A, Smirnov I, Keyes TJ, et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 2015 Jul 16;523(7560):337-41. doi: 10.1038/nature14432
Iliff JJ, Chen MJ, Plog BA, et al. Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury. J Neurosci. 2014 Dec 3;34(49):16180-93. doi: 10.1523/JNEUROSCI.3020-14.2014
Iliff JJ, Wang M, Liao Y, et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Sci Transl Med. 2012 Aug 15;4(147):147ra111. doi: 10.1126/scitranslmed.3003748
Sur le web :
Thomas JL, Jacob L, Boisserand L. Système lymphatique et cerveau. Med Sci (Paris) 2019;35(1): 55–61. doi: 10.1051/medsci/2018309
Goulay R, Gaberel T, Vivien D. La révolution cérébrale : le système glymphatique. La Lettre du Neurologue. 2016 oct;20(8):2-4.
